Um die Lizenzinformationen zu sehen, klicken Sie bitte den gewünschten Inhalt an.
Name:
Elementaranalyse
03.11.2019
1
Ein flüssiger Stoff wird verbrannt. Es wurden 5 g des Stoffes eingewogen.
Die Masse des Calciumchlorids stieg um 8,18 g, die des Natronkalks um 15,0 g.
Die Masse des Calciumchlorids stieg um 8,18 g, die des Natronkalks um 15,0 g.
- Bestimmen Sie die Verhältnisformel.
- Werden im zweiten Aufbau 0,1 g des Stoffes eingewogen und bei Raumtemperatur verdampft, so wird der Kolbenprober um 55 mL herausgedrückt.
Bestimmen Sie mit Hilfe der Zustandsgleichung für ideale Gase die molare Masse des Stoffes, indem Sie erst einmal die Stoffmenge berechnen. - Stellen Sie aus den Daten eine Summenformel auf und zeichnen Sie mindestens 3 verschiedene, passende Strukturformeln.
p⋅V=n⋅R⋅T
p: Druck
V: Volumen
n: Stoffmenge in mol
R: Gaskonstante, R=8,31 J/mol/K
T: Temperatur in K
Standardbedingungen sind
p = 101325 Pa und T=293 K
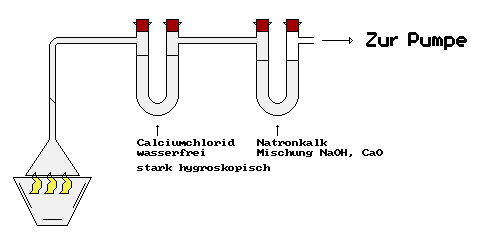
Aufbau zur Elemenaranalyse
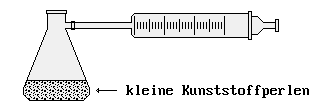
Aufbau zum Ermitteln der molaren Masse
n(CO2)=0,341 mol
n(H2O)=0,454 mol
n(H)/n(C)=2,66 = 8/3
Summenformel; C3H8
Prüfung bei (2) ergibt M = 44 g/mol
Angaben zu den Urhebern und Lizenzbedingungen der einzelnen Bestandteile dieses Dokuments finden Sie unter
https://www.tutory.de/entdecken/dokument/e3899012
https://www.tutory.de/entdecken/dokument/e3899012


