Chiralität und D/L-Konfiguration in der Fischer-Projektion
Chirale ("händische") Moleküle zeichnen sich dadurch aus, dass sie sich nicht mit ihrem Spiegelbild zur Deckung bringen lassen (so wie die rechte und die linke Hand). Das ist dann der Fall, wenn sie mindestens ein asymmetrisches C-Atom (also eines, das vier echt verschiedene Substituenten besitzt) aufweisen und keine Spiegelachse besitzen ("Meso-Verbindung"). Wässrige Lösungen von Stoffen mit chiralen Moleküle sind i.d.R. optisch aktiv.
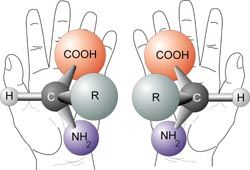
Um entsprechende Moleküle auch zweidimensional darstellen und voneinander unterscheiden zu können, gibt es die so genannte Fischer-Projektion. Diese wird so erzeugt:
- Das am höchsten oxidierte C-Atom kommt nach oben. Vor dort aus wird die Kohlenstoffkette so angeordnet, dass die Substituenten schräg nach vorne zum Betrachter hin zeigen. Die Kette zeigt damit schräg vom Betrachter weg.
- Die Kohlenstoffkette wird für die Fischerprojektion senkrecht gezeichnet, die Seitenketten im rechten Winkel dazu nach außen. Die Ausrichtung entspricht dabei der der Substituenten im 3D-Modell.
(Man kann sich auch vorstellen, dass das Molekül wir beschrieben ausgerichtet und dann auf das Papier "flachgedrückt" wird.)
Abb. 2 - Links: L-Weinsäure, rechts: D-Weinsäure, jeweils in Fischerprojektion. Die Buchstaben R und S gehören zu einer anderen Benennungsweise, der so genannten CIP-Konvention.
Benennung chiraler Moleküle
Wenn keine Symmetrie wie bei der Meso-Weinsäure vorliegt, können die verschiedenen Konfigurationen chiraler Moleküle in den Namen einbezogen werden. Eine Möglichkeit ist oben angedeutet (R bzw. S nach der CIP-Konvention), in vielen Fällen genügt es aber, die Ausrichtung der Substituenten am untersten asymmetrischen C-Atom anzugeben. Zeigt die funktionelle Gruppe nach rechts, so handelt es sich um die D-Form, zeigt sie nach links, so handelt es sich um die L-Form (siehe oben).
Das funktioniert natürlich nur, wenn für die verschiedenen Stereoisomere auch jeweils eigene Trivialnamen existieren - sonst benötigen wir eine umfangreichere Nomenklatur wie die CIP-Konvention. Für uns genügt jedoch die einfachere Variante mit D und L.
https://www.tutory.de/entdecken/dokument/e4ac54a3
Arten von Stereoisomerie
Asymmetrische Kohlenstoffatome werden auch als Stereozentren bezeichnet. Die maximale Anzahl möglicher Stereoisomere n lässt sich in Abhängigkeit von der Anzahl der Stereozentren k berechnen:
Dabei verhalten sich die Stereoisomere jeweils paarweise wie Bild und Spiegelbild. Diese Paare werden als Enantiomere bezeichnet. Die Paare sind untereinander zwar nicht zur Deckung zu bringen, verhalten sich jedoch auch nicht wie Bild und Spiegelbild. Sie werden als Diastereomere bezeichnet.
Beispiel: D- und L Erythrose sind ein Enantiomerenpaar, ebenso D- und L-Threose. Threose und Erythrose sind hingegen Diastereomere:
Nur scheinbar verschieden: Meso-Formen
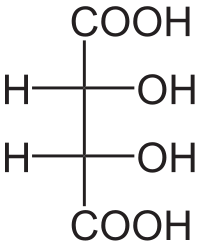
Besitzt ein Molekül mit asymmetrischen C-Atomen eine Spiegelachse oder eine Punktsymmetrie, so ist es insgesamt dadurch nicht mehr chiral. Eine solche Form wird als Meso-Form bezeichnet und reduziert die maximale Anzahl der Stereoisomere, da jeweils zwei mögliche Isomere stattdessen identisch sind.
D/L-Angaben sind nicht möglich.
https://www.tutory.de/entdecken/dokument/e4ac54a3


