Heute haben wir eine Menge über Metalle gelernt. Ähnlich wie bei Kohlenstoff entsteht bei der Reaktion eines Metalls mit Sauerstoff eine neue Verbindung. Aufgrund des englischen Namens für Sauerstoff wird die Reaktion, bei der ein Metall mit Sauerstoff reagiert, als Oxidation bezeichnet.
Die neu gebildete Verbindung wird als Metalloxid bezeichnet und wir kennen bereits viele von ihnen. Magnesiumoxid wird in der Gymnastik verwendet, um den Griff zu erleichtern. Rost ist der gebräuchliche Name für Eisenoxid. Die grüne Farbe auf einigen Dächern ist das Oxidationsprodukt von Kupfer, Kupferoxid. Obwohl Kohlenstoff kein Metall ist, kann er auch einer Oxidationsreaktion unterzogen werden, bei der Kohlendioxid gewonnen wird.
Bevor du anfängst, die Lücken zu füllen, lies den ganzen Text mindestens einmal.
- Beispiel:
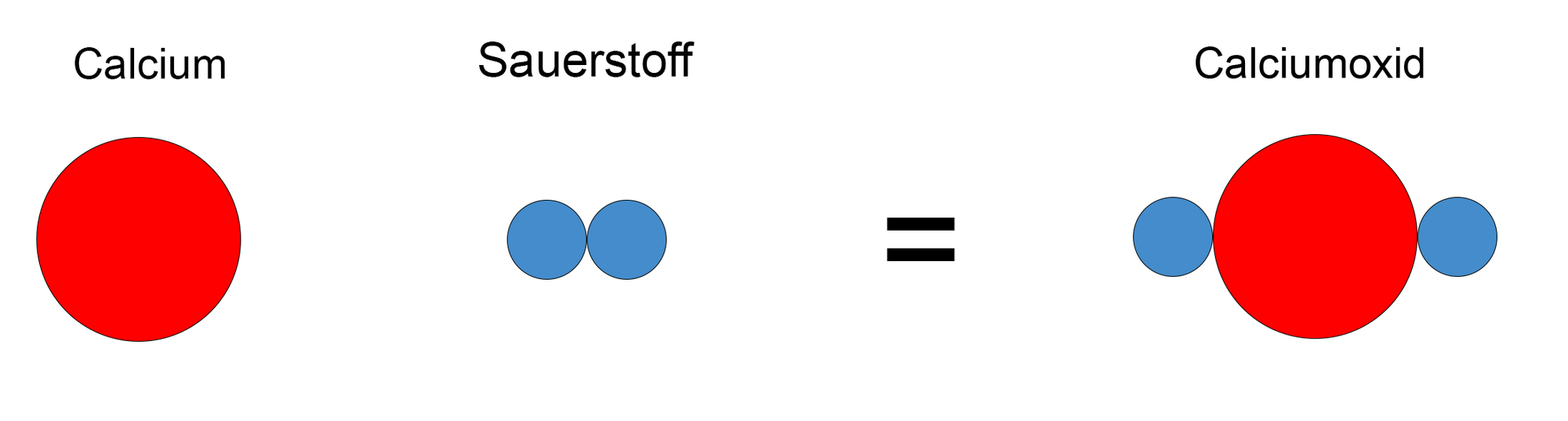
https://www.tutory.de/entdecken/dokument/9138c914


