Magnesium ist ein Mineralstoff der für viele Pflanzen aber auch den Menschen essentiell ist, das heißt es muss dem Köper in ausreichender Menge zugeführt werden.
Natürlich geht es hier nicht um das metallene Magnesium sondern um Magnesium-Ionen.
Auf diesem Arbeitsblatt geht es darum, sich etwas genauer mit Magnesium zu beschäftigen. Es geht biologische Aspekte, welche Bedeutung Magnesium im Körper hat und auch die Frage, in welcher Form man die Magnesium-Ionen zu sich nehmen sollte.

Nun sollte dir klar sein, wie wichtig Magnesium für den Körper ist. Magnesium geht aber im Laufe der Zeit im Körper verloren und muss daher über die Nahrung ersetzt werden. Das kann auf zwei Arten geschehen: über Magnesium-reiche Nahrungsmittel oder über Nahrungsergänzungsmittel.
- Informiere dich über die Arten an Verbindungen, die als Nahrungsergänzungmittel angeboten werden. Es sollten mehr als 5 verschiedene sein.
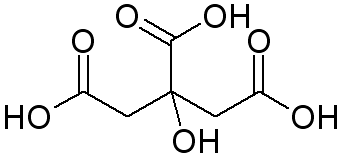
- Suche zum Namen der Verbindung auch die Formel heraus: sowohl die Summenformel, also auch die Strukturformeln der Anionen in Lewisschreibweise.
Wie du jetzt festgestellt haben wirst, gibt es tatsächlich eine große Menge an möglichen Präparaten, die zur Auswahl stehen. Wenn man danach fragt, welche Magnesium-Verbindung die beste ist gibt es ein paar Aspekte, die man betrachten könnte:
Wie gut kann der Körper die Verbindung nutzen? Dabei geht es auch um Löslichkeit und wie gut das Magnesium-Ion im Körper aufgenommen werden kann.

Wie wirkt sich die chemische Verbindung auf den Körper aus. Dabei geht es vor allem um die Auswirkungen im Verdauungstrakt im chemischen Sinne.
Welche Bedeutung hat das Anion? Einige Anionen haben für sich auch positive Wirkung. Vielleicht gibt es auch negative Effekte?
https://www.tutory.de/entdecken/dokument/2bfff5a9
Eines der Magnesium-Präparate ist Magnesium-Citrat. Allerdings gibt es zwei Varianten: Magnesium(hydrogen)citrat und Trimagnesiumdicitrat. Bei dem Citrat-Ion handelt es sich um das Säure-Rest-Ion der Zitronensäure.
Liest man die Bewertungen von Online-Shops zu den Magensium-Citrat-Präparaten, so gibt es immer wieder einmal Bemerkungen zum Geschmack. Die einen berichten von einem sauren Geschmack, andere meinen, der Geschmack ist neutral. Teilweise wird es auch als "seifig" bezeichnet. Solche Geschmackseindrücke haben etwas mit dem pH-Wert zu tun.
Bei der Bewerbung eines Produkten und auch in den Bewertungen von Käufer spielt oft eine Rolle, wie viel Magnesium wirklich ein Produkt enthält. Denn neben dem Magnesium-Ion, um das es hauptsächlich geht, enthalten die Präparate auch die Anionen, die ebenfalls ein Teil des Gesamtgewichtes ausmachen.
So müsste man also die Molare Masse der Verbindung mit dem Massenanteil an Magnesium darin vergleichen.

https://www.tutory.de/entdecken/dokument/2bfff5a9
Führt man Berechnungen zu Massen rund um Mineralien und salzartige Verbindungen durch, so muss man immer beachten, dass neben dem eigentlichen Salz, bestehend aus Anion und Kation, oft auch sogenanntes Kristallwasser eingelagert ist.

Dieses Kristallwasser ist so in die Gitterstruktur des Salzes mit seinen Ionen eingelagert, dass das Salz scheinbar trocken ist.Solche Hydrate
gibt es vor allem bei Salzen, die größere Ionen haben, wie beim Kupfersulfat rechts das Sulfat-Ion oder eben auch bei den Citrat-Ionen.Wenn man also den Anteil von Magnesium an einer Verbindung bestimmen will, muss man wissen, ob es ein wasserfreies Produkt ist, oder ob es Wasser eingelagert hat. In der Formel wird es dann zum Beispiel so angegeben:
Na2SO4 · 10 H2O
Diese Schreibweise bedeutet, dass auf 1 mol Natriumsulfat 10 mol Wasser kommen.
Das folgende Bild ist die Beschriftung einer Magnesiumcitrat-Packung. Es ist nichts weiter angegeben, um welche Art es sich handelt. In den Kommentaren wird es als "sauer" schmeckend beschrieben.
Laut Aufschrift besteht das Produkt zu 100% aus Magnesiumcitrat, sollte also keine Füllstoffe.

- Wie groß ist der Magnesiumanteil?
- Kontrolliere anhand der Angaben, ob das Produkt wasserfrei ist oder nicht. Und wieviel Wasser enthalten ist.
*seufz* Du siehst, dass ist alles nicht so einfach. Mal eben schnell ein Magnesium-Präparat zu kaufen ist gar nicht so einfach, wenn man etwas Ahnung von Chemie hat. Aber ... und das ist ja auch etwas ... man kann sich nichts vormachen lassen!
https://www.tutory.de/entdecken/dokument/2bfff5a9


