Warum ist eigentlich die Verbrennungs-Reaktion von Methan exotherm? Da wir inzwischen wissen, was die Moleküle in Methan, Sauerstoff O₂ bei den Edukten und Wasser und Kohlendioxid zusammenhält, können wir uns das nun genauer überlegen.
1. Schritt: Das Ausgleichen der Reaktionsgleichung
Das ist wichtig, weil wir wissen müssen, wie viele Bindungen welcher Art gebrochen und neu erstellt werden müssen. Falls du noch unsicher bist, was die Symbolschreibweise betrifft, so kannst du die Moleküle darunter anschauen und die Anzahl der jeweiligen Atome betrachten.


2. Schritt: Wieviel Energie steckt in den Bindungen?
Oder anders formuliert, wieviel Energie müsste man aufbringen, um die ganzen Bindungen der Moleküle aufzubrechen?
Nutzt die schon vorhandene Tabelle mit den Werten zu den verschiedenen Bindungsarten und rechnet mit Hilfe der Tabelle alles notwendige aus.
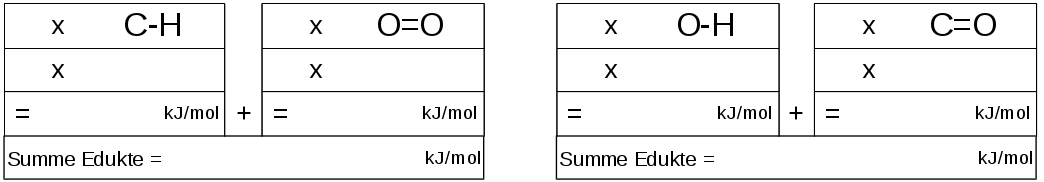
3. Schritt: Eintragung ins Energiediagramm (wird im Plenum besprochen)

https://www.tutory.de/entdecken/dokument/58930bb0


