Es handelt sich um Übungsaufgaben am Ende einer durch zahlreiche Ausfälle sehr zerfaserten Unterrichtseinheit. Ziel ist es, den SuS entstandene Lücken bewusst zu machen und durch Rückfragen weitere Wiederholungen zu planen.
pIn der abgeschlossenen Einheit habt ihr euch mit Säure-Base-Reaktionen nach der Definition nach Brønsted (und damit: Protolysereaktionen) befasst. Nach dem Lehrplan kam es dabei auf die folgenden Themen an:/pp/pulliWiederholung der Namen und Summenformeln verschiedener anorganischer Säuren und deren Salze/lili Säure-Base-Theorie nach Brønsted/liliAnwenden der Säure-Base-Theorie nach Brønsted: /liliIonengleichung von Protolysereaktionen/liliBerechnungen: Masse, molare Masse, Stoffmenge und Konzentration von Lösungen/liliDefinition des Begriffes pH-Wert, Berechnung mit Hilfe der Konzentration an Oxonium-Ionen/li/ul
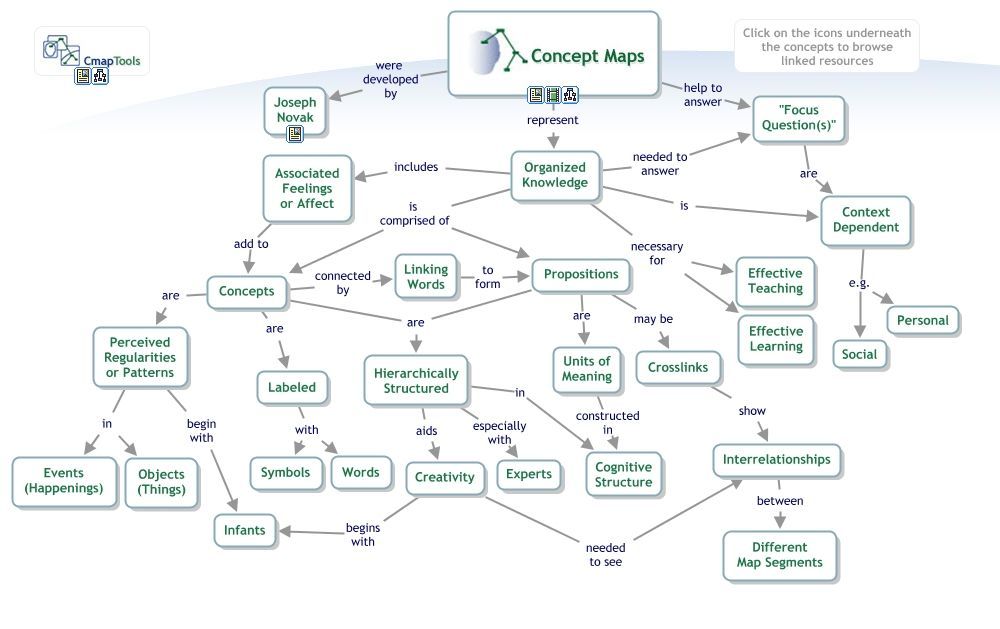
Concept-Map
- Erstelle dazu nach den bekannten Regeln eine Concept Map zum Thema Protolysereaktionen (mögliche Stichwörter siehe unten).
- Vergleiche die Concept Map mit der zu Beginn der Einheit erstellten Version, um den Zuwachs zu erkennen.
- Schicke das Ergebnis per Mail an mich.
Persönliche Formelsammlung

- Wichtige Reaktionsgleichungen
- Wichtige mathematische Formeln
- (wichtige Definitionen, falls gewünscht)
https://www.tutory.de/entdecken/dokument/9b5d1628
Übungsaufgaben
Thema 1: Chemisches Rechnen
- Es werden 50 l Schwefeldioxid durch Oxidation von Schwefel hergestellt. Berechne die dafür notwendige Masse an Schwefel. (Lösung 1)
- Berechne das Volumen an Schwefeldioxid, welches bei der Oxidation von 50 t Schwefel freigesetzt wird. (Lösung 2)
- 7t Cuprit (Cu2S) werden mit Sauerstoff zu Kupfer(I)-oxid und Schwefeldioxid oxidiert. Berechne:
-die dabei enstehende Masse an Kupfer(I)-oxid
-das dazu notwendige Volumen an Sauerstoff
-das dabei freigesetzte Volumen an Schwefeldioxid (Lösung 6, Reaktionsgleichung als Hilfestellung unten rechts hinterlegt)
Thema 2: (Protolyse)reaktionen
- Chlorwasserstoffgas reagiert mit Wasser.
- Salzsäure reagiert mit Zink zu Wasserstoff und Zinkchloridlösung.
- Salzsäure reagiert mit Kalilauge.
- Ammoniak reagiert mit Wasser.
- Kupfer(II)oxid reagiert mit Kohlenstoff.
Thema 3: Neutralisation
1. Natriumchlorid (Kochsalz)
2. Natriumhydrogensulfat, Dinatriumsulfat
3. Ammoniumchlorid
4. Calciumnitrat
- Natronlauge reagiert mit Salzsäure.
- Natronlauge reagiert mit Schwefelsäure (Achtung, zwei Salze sind möglich).
- Ammoniak reagiert mit Chlorwasserstoff (beides Gase).
- Kalkwasser (Ca(OH)2) reagiert mit Salpetersäure.
- Berechnen Sie c(HCl).
- Berechnen Sie den pH-Wert der Salzsäure.
https://www.tutory.de/entdecken/dokument/9b5d1628
Lösungen
https://www.tutory.de/entdecken/dokument/9b5d1628


