Grundlagen biologischer Reaktionen: Energie
Biochemische Reaktionen der Energieumwandlung, bei denen Energie freigesetzt wird, bezeichnet man als exergonische Reaktionen (A). Die abgegebene Wärmeenergie heißt Reaktionsenthalpie. Reaktionen, für die Energie benötigt wird, sind endergonische Reaktionen (B).
Beim Abbau von Nährstoffen entstehen aus verhältnismäßig großen Molekülen viele kleine Moleküle, die sich in unterschiedlicher Weise bewegen und schwingen. Das führt dazu, dass die Anzahl der möglichen Anordnungen der beteiligten Teilchen zunimmt. Damit nimmt auch ihre Unordnung zu. Man bezeichnet dies als Zunahme der Entropie, wobei Entropie ein Maß für die Unordnung ist. Enthalpie hingegen bezeichnet die abgegebene bzw.aufgenommene Wärmemenge einer Reaktion.
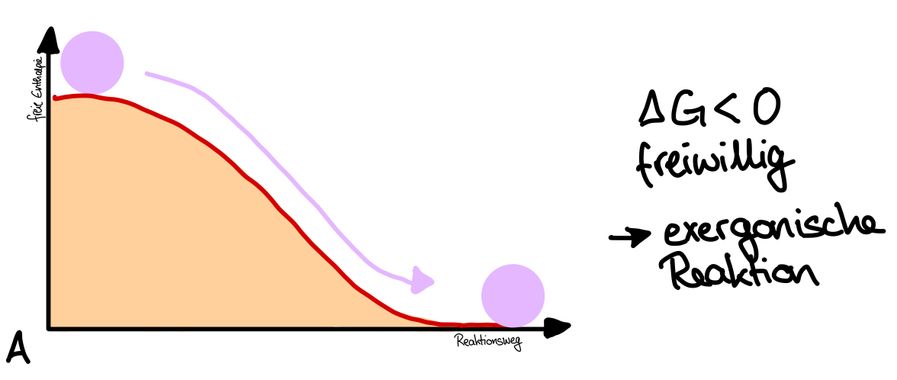
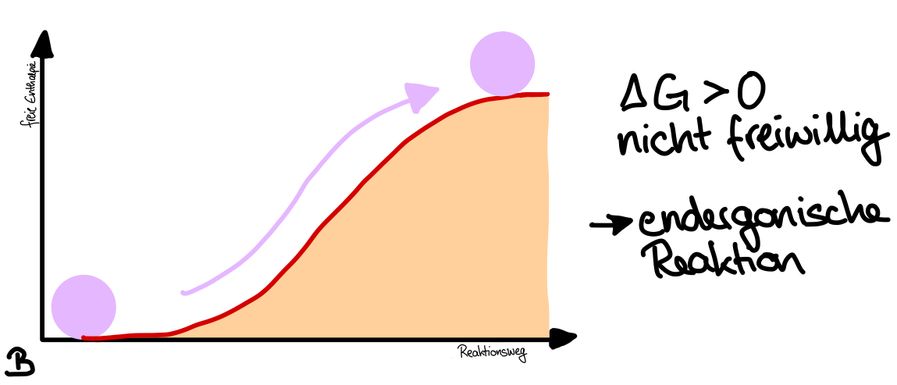
Der amerikanische Physiker Josiah Willard Gibbs erkannte im 19. Jahrhundert, dass es möglich ist, aus den Änderungen der Enthalpie und der Entropie zu berechnen, ob eine chemische Reaktion exergonisch ist, also freiwillig abläuft, oder ob sie endergonisch ist und damit nicht freiwillig abläuft. Er definierte die Gibbs-Energie G, die auch als freie Enthalpie bezeichnet wird. Wenn ΔG für eine Reaktion negativ ist, läuft sie freiwillig ab, ist ΔG positiv, läuft sie nur unter Energiezufuhr ab.
Aktivierungsenergie und Katalysatoren
Bei der Verbrennung eines Zuckerwürfels entsteht eine Flamme. Es handelt sich um eine exergonische Reaktion. Da die freie Enthalpie dieser Reaktion negativ ist, sind die Voraussetzungen für den freiwilligen Ablauf der Reaktion erfüllt. Dennoch brennt der Zuckerwürfel nicht von selbst. Auch der Versuch, einen Zuckerwürfel mit dem Feuerzeug zu entzünden, gelingt nicht. Das heißt, die zugeführte Wärmeenergie reicht nicht aus. Der Ablauf der chemischen Reaktion ist gehemmt.
Die Energie, die notwendig ist, um eine Reaktion in Gang zu setzen, wird als Aktivierungsenergie bezeichnet. Stoffe, die die Aktivierungsenergie herabsetzen, nennt man Katalysatoren. Die Herabsetzung der Aktivierungsenergie beschleunigt die Reaktion.



