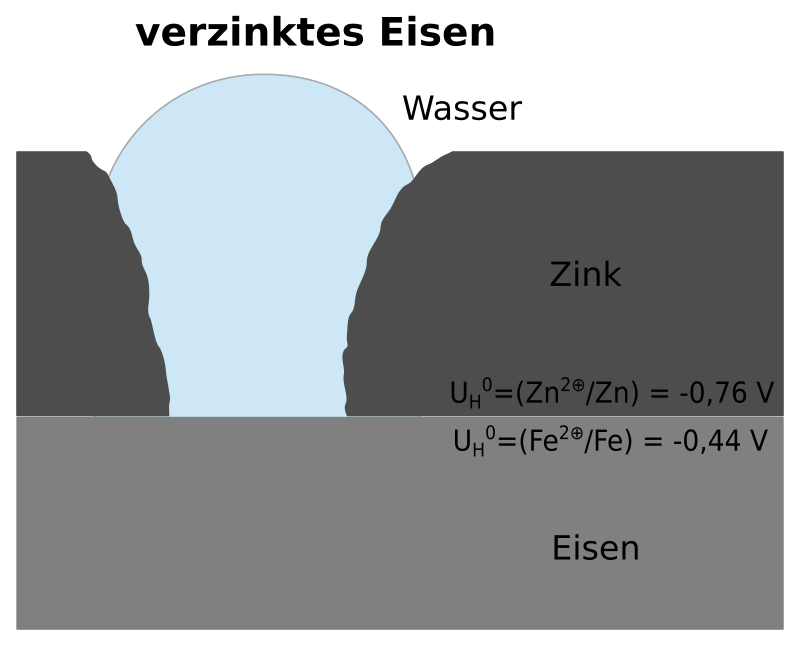
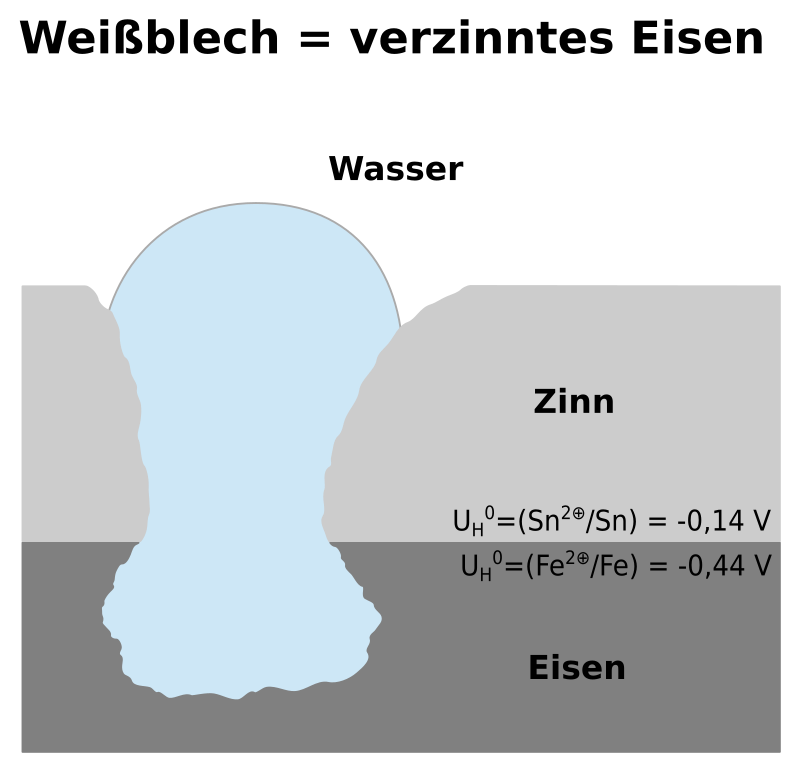
Die wichtigsten Metalle für den Korrosionsschutz von Eisen sind Zink und Zinn. Zink wird vor allem im Außenbereich bei Werkstücken aus Eisen und Stahl eingesetzt. Zinn wird dagegen eher als Überzug von Blech verwendet, was das sogenannte Weißblech ergibt, wegen der hellen Farbe des Zinns. Verwendung findet es vor allem in Konservendosen.
Beim Verzinken wird Stahl mit einer dünnen Schicht Zink versehen, um ihn vor Korrosion zu schützen. Im Gegensatz zu anderen Beschichtungen bietet Zink neben der abschirmenden Wirkung auch einen aktiven Korrosionsschutz, indem es durch eigenes Oxidieren verhindert, das das edleren Eisen korrodiert.
Im Wasser vorhandene Protonen greifen zwar auch das Eisen an, entziehen dem Eisen Elektronen und bilden Wasserstoff, dass Eisen erhält aber Elektronen vom unedleren Zink, dass selber oxidiert und sich als Zn²⁺ -Ionen im Wasser lösen. Dadurch wird verhindert, dass das Eisen oxidiert.
https://www.tutory.de/entdecken/dokument/b99a0980
https://www.tutory.de/entdecken/dokument/b99a0980


