Die Ionenbindung ist eine Art der chemischen Bindung. Alle Atome streben einen energetisch günstigen Zustand an, der durch eine abgeschlossene äußere Elektronenschale gegeben ist. Im Periodensystem haben aber nur die Atome der Edelgase diese stabile Besetzung. Alle anderen Atome erreichen diesen Zustand durch chemische Reaktionen bzw. Bindungen mit anderen Partnern, wobei es verschiedene Möglichkeiten für sie gibt.Die Elemente der ersten Hauptgruppe (Alkalimetalle) oder der zweiten Hauptgruppe (Erdalkalimetalle) haben nur ein bzw. zwei Elektronen auf der äußeren Schale. Sie können die abgeschlossene Schale leicht durch Abgabe von diesen Elektronen unter Bildung von positiv geladenen Kationen erreichen.
z. B.: Na → Na+ + e-
Den Atomen der Elemente der siebenten Hauptgruppe (Halogene) oder der sechsten Hauptgruppe fehlen nur ein bzw. zwei Elektronen zur Auffüllung der Schale. Sie können die abgeschlossene Schale leicht durch Aufnahme von Elektronen unter Bildung von negativ geladenen Anionen erreichen.
z. B.: Cl + e- → Cl-
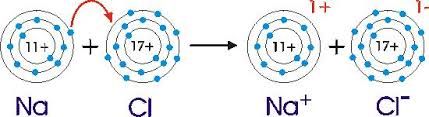
Wenn man Natrium mit Chlor reagieren lässt, geben also die Natriumatome ihre Außenelektronen an Chloratome.
Es entstehen positiv geladene Natriumionen (Kationen) und negativ geladene Chlorionen (Anionen).
- Lithium und Fluor
- Kalium und Brom
- Magnesium und Chlor
https://www.tutory.de/entdecken/dokument/beispiele-zur-ionenbindung


