Die Sprache der Chemie
Die Sprache der Chemie
Ein Beispiel:
Das Molekül Schwefelsäure setzt sich folgendermaßen zusammen:
2 Wasserstoffatome (H), 1 Schwefelatom (S), 4 Sauerstoffatome (O).
Wir könnten das Molekül jetzt natürlich folgendermaßen anschreiben:
HHSOOOO
Stattdessen wird aber in der Chemie diese Schreibweise verwendet:
H2SO4
Für das Anschreiben chemischer Formeln gelten folgende Regeln:
Aufbau | Schreibweise | Erklärung |
|---|---|---|
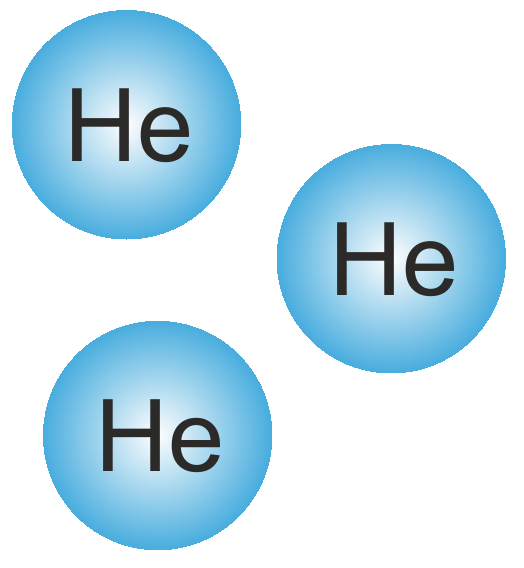
3He | Drei einzelne (nicht miteinander verbundene) Heliumatome. | |
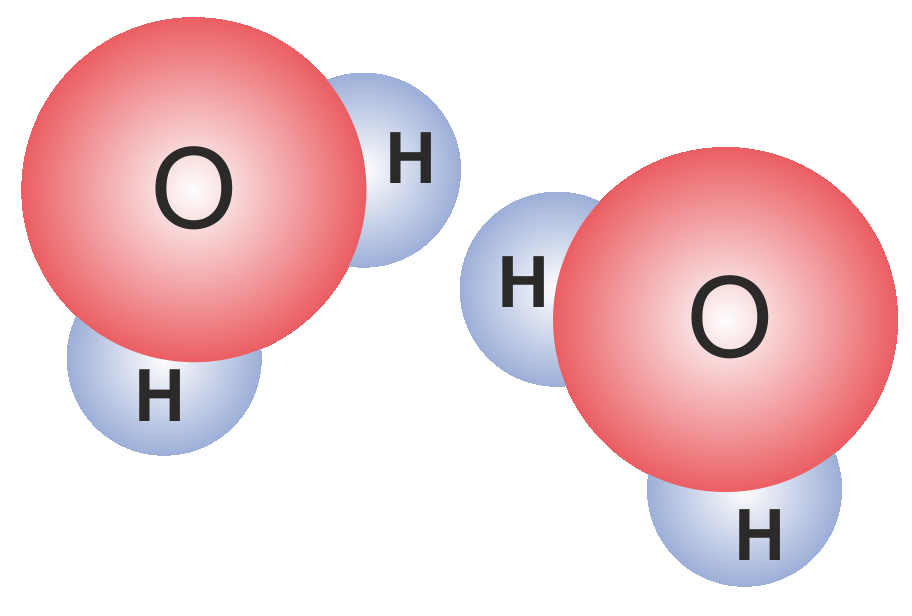
2H2O | Zwei Wassermoleküle, jedes bestehend aus zwei Wasserstoffatomen und einem Sauerstoffatom. | |
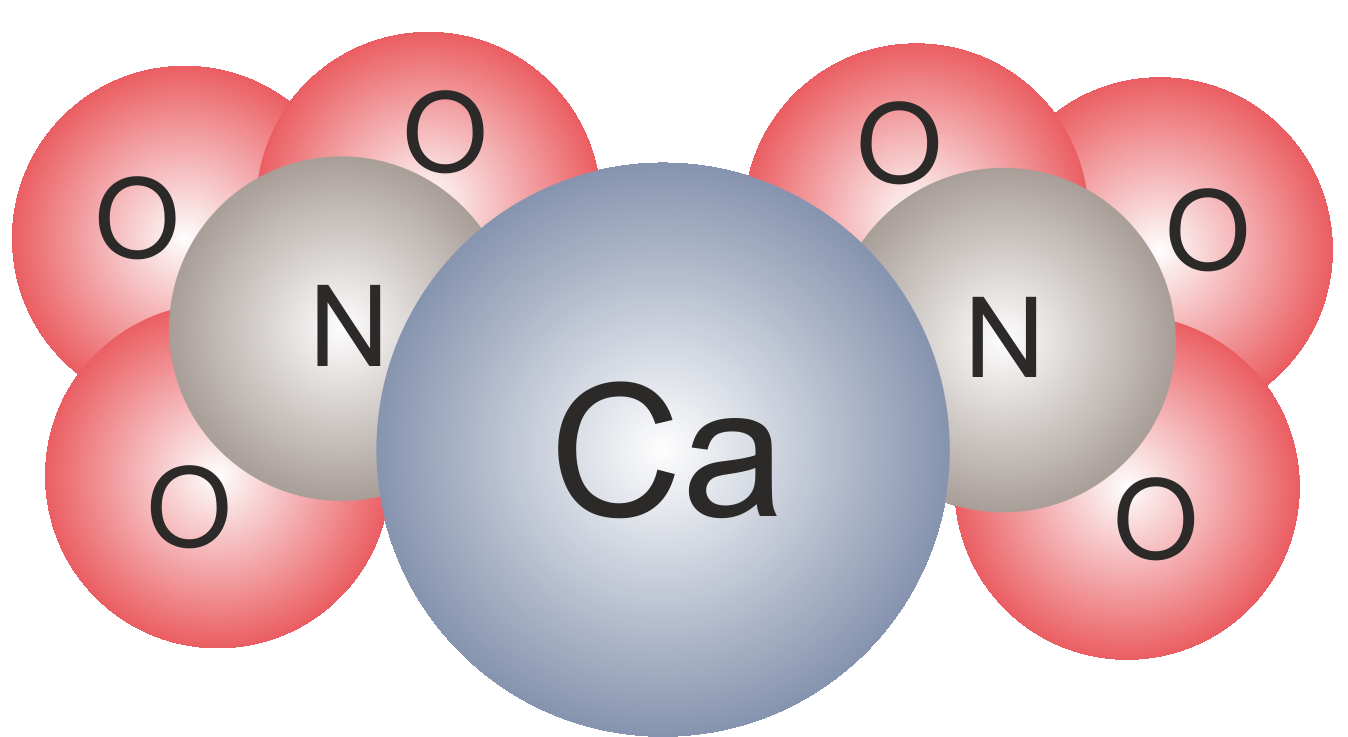
Ca(NO3)2 | Ein Atom Calcium und zwei Atomgruppen (NO3). Bestehend je aus einem Stickstoffatom und drei Sauerstoffatomen. (Die Klammer zeigt an, dass diese Atomgruppe mehrfach vorkommt, die Zahl hinter der Klammer zeigt an, wie oft.) |
https://www.tutory.de/entdecken/dokument/die-sprache-der-chemie-2
Reaktionsgleichungen:
Reaktionsgleichungen dienen zur einfachen Beschreibung chemischer Reaktionen.
Auf der linken Seite werden die Ausgangsstoffe angeschrieben, auf der rechten Seite das Ergebnis (Produkt) der chemischen Reaktion:
Beispiel 1:
Stickstoff (N) und Wasserstoff (H) verbinden sich zu Ammoniak (NH3).
N2+3H2→2NH3
Beispiel 2:
Wasserstoff (H) und Sauerstoff (O2) verbinden sich zu Wasser (H2O). Es ist aber auch möglich, Wasser in seine Bestandteile zu zerlegen (Elektrolyse).
Eine chemische Reaktion ist also in beide Richtungen möglich.
2H2+O2↔2H2O
Beispiel 3:
Propangas (C3H8) verbrennt durch den Sauerstoff (O2) in der Luft zu Kohlendioxid (CO2) und Wasser (H2O).
C3H8+O2→CO2+H2O
Beispiel 3 zeigt im Moment nur ein Reaktionsschema und noch keine Reaktionsgleichung, denn die Atomzahlen auf der linken und der rechten Seite stimmen noch nicht überein. Wir müssen diese nun schrittweise anpassen, denn links und rechts muss die Summe der Atome auch nach einer chemischen Reaktion gleich sein.
https://www.tutory.de/entdecken/dokument/die-sprache-der-chemie-2
Schritt-für-Schritt zur Reaktionsgleichung
1. Schritt:
Sinnvoll ist es, zunächst mit jenen Atomen zu beginnen, die auf der linken und rechten Seite nur in jeweils einem Molekül vorkommen. In unserem Beispiel also mit C und H.
Wir gleichen zunächst einmal die Kohlenstoffatome aus. Auf der linken Seite kommen 3 Kohlenstoffatome vor, also müssen auch auf der rechten Seite 3 Kohlenstoffatome vorkommen:
aus
C3H8+O2→CO2+H2O
wird
C3H8+O2→3CO2+H2O
2. Schritt:
Nun gleichen wir die Wasserstoffatome aus.
Auf der linken Seite kommen 8 Wasserstoffatome vor, also müssen auch auf der rechten Seite 8 Wasserstoffatome (bzw. 4 Wassermoleküle) vorkommen:
aus
C3H8+O2→3CO2+H2O
wird
C3H8+O2→3CO2+4H2O
3. Schritt:
Zum Schluss müssen wir noch die Sauerstoffatome ausgleichen. Rechts stehen 3⋅2+4=10 Sauerstoffatome, also müssen auch links 10 Sauerstoffatome bzw. 5O2 Moleküle vorhanden sein:
aus
C3H8+O2→3CO2+4H2O
wird
C3H8+5O2→3CO2+4H2O
https://www.tutory.de/entdecken/dokument/die-sprache-der-chemie-2
Und jetzt du:
- Vier Stickstoffmoleküle, bestehend aus je zwei Stickstoffatomen (N).
- Zwei Moleküle Kohlenmonoxid, bestehend aus je einem Kohlenstoff (C) und einem Sauerstoffatom (O).
- Ein Molekül Rübenzucker, bestehend aus zwölf Kohlenstoff- (C), zweiundzwanzig Wasserstoff- (H) und elf Sauerstoffatomen (O).
Erdgas besteht im Wesentlichen aus Methan (CH4). Mit Luft (O2) verbrennt es zu Kohlendioxid und Wasser. Stelle die Reaktionsgleichung auf und gleiche sie aus.
https://www.tutory.de/entdecken/dokument/die-sprache-der-chemie-2
Schwefeldioxid (SO2) reagiert mit Luft (O2) zu Schwefeltrioxid (SO3).
Stelle die Reaktionsgleichung auf und gleiche sie aus.
Beim Rosten reagiert Eisen (Fe) mit Luft (O2) zu Fe2O3.
Stelle die Reaktionsgleichung auf und gleiche sie aus.
https://www.tutory.de/entdecken/dokument/die-sprache-der-chemie-2
Das zur Füllung von Gasfeuerzeugen verwendete Butangas (C4H10) verbrennt mit Sauerstoff (O2) zu Kohlendioxid (CO2) und Wasser (H2O).
Stelle die Reaktionsgleichung auf und gleiche sie aus.
Noch Unklarheiten?
Vielleicht hilft dir die Simulation zum Thema etwas weiter. Folge dem QR-Code.
https://www.tutory.de/entdecken/dokument/die-sprache-der-chemie-2


