Dieser Text wurde zur Klausurvorbereitung zusammengestellt und behandelt das zweite Thema, Farbstoffe und Farbigkeit.
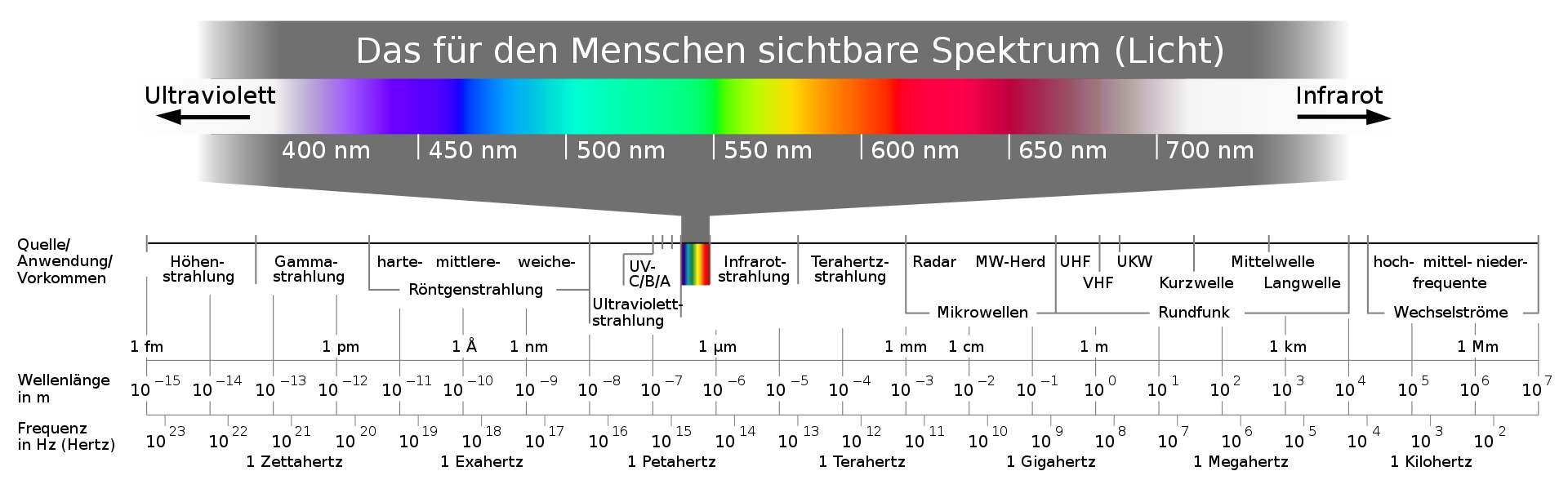
Warum erscheinen Stoffe farbig?
Wenn Menschen einen Gegenstand als farbig wahrnehmen, muss Licht bestimmter Wellenlängen in ihr Sehorgan, das Auge, gelangen. Dafür gibt es zwei Gründe:
Der Gegenstand absorbiert einen Teil des einfallenden, weißen Lichts durch Anregung seiner Atome, Elektronen und Moleküle und reflektiert das Licht der übrig bleibenden Wellenlängen. Wahrgenommen wird also die Komplementärfarbe des absorbierten Lichts.
Der Gegenstand emittiert selbst Licht bestimmter Wellenlängen - diese ergeben dann die Farbwahrnehmung des Gegenstandes für den Beobachter.
Farbmischung
Das Licht trifft im Auge auf Lichtrezeptoren (Zapfen), die jeweils auf bestimmten Wellenlängenbereich reagieren. Im Gehirn wird daraus eine Mischfarbe zusammengesetzt.
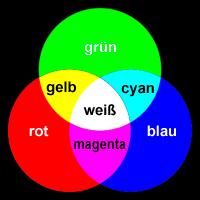
Es gibt zwei Arten der Farbmischung - additiv und subtraktiv. Bei der additiven Farbmischung wird aus Lichtstrahlen verschiedener Farben/Wellenlängen eine Mischfarbe erzeugt (Bsp.: Scheinwerfer in den Grundfarben rot, grün und blau ergeben zusammen weiß, siehe rechts).
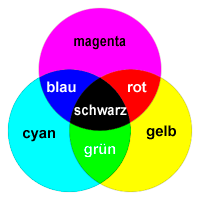
Bei der subtraktiven Farbmischung werden aus weißem Licht einzelne Wellenlängenbereiche entfernt, so dass die Mischfarbe aus einer Restmenge übriggebliebener Wellenlängen entsteht (Bsp.: Wasserfarben mischen, siehe rechts).
https://www.tutory.de/entdecken/dokument/e37d0a9d
Welche Strukturen führen zu Farbigkeit?
Ein gutes Beispiel für die strukturellen Voraussetzungen für Farbigkeit ist der rote Tomatenfarbstoff Lycopin:
- Tipp: Betrachte die Strukturformel unter Beachtung der Ausführungen auf Seite 1. Was kommt als Grund in Frage?
- Tipp: Wie kann die entsprechende Struktur nachgewiesen oder zur Reaktion gebacht werden? Was müsste sich ändern?
Um Dein Ergebnis zu überprüfen kannst Du das Versuchsprotokoll hinter dem folgenden QR-Code anschauen. Ergänze dann den Ergebnissatz:

Verantwortlich für die Farbigkeit sind also die (also alternierend mit auftretenden) .
https://www.tutory.de/entdecken/dokument/e37d0a9d
Auswertung des Versuchs (I)
Das relativ ausgedehnte System delokalisierter π-Elektronen in Lycopin führt zu einer Absorption der Komplementärfarbe zu rot. Je mehr das System durch die Bromierung von Doppelbindungen verkleinert wird, desto mehr verändert sich der absorbierte Wellenlängenbereich, so dass die Farbwahrnehmung über gelb und grün bis hin zu blau wechselt.
Molekülstruktur und Farbe
Bei verschiedenen Farbstoffen kann es unterschiedliche Gründe für die Farbigkeit geben:
anorganische Farbstoffe: häufig Elektronen in Metallbindungen/Ionengittern
organische Farbstoffe: häufig delokalisierte π-Elektronen in konjugierten Doppelbindungen
Metalle/Mineralien/Diamanten: Elektronen in Leitungsbändern
Bei Emission oder Lichtbrechung kommen weitere Strukturen/Gründe in Frage, die jedoch hier nicht thematisiert werden.
Um Elektronen in Einfachbindungen anzuregen, wird energiereiches Licht im Ultraviolettbereich benötigt. Leichter beeinflussbare Elektronen wie etwa solche in Systemen delokalisierter π-Elektronen (bei konjugierten Doppelbindungen) führen hingegen häufig zu einer Absorption im sichtbaren Bereich. Atomgruppen mit solchen Mehrfach-bindungen werden daher als Chromophore (Farbträger, vgl. Phosphor: Lichtträger) bezeichnet. Ohne weitere Einflüsse beginnt Absorption im sichtbaren Bereich bei etwa neun konjugierten Doppelbindungen (Wechsel von absorbiertem UV-Licht zu absorbiertem violettem Licht).
Endständige Substituenten, die durch Mesomerie Elektronen in das System hinein geben können (Elektronendonoren) werden als Auxochrome bezeichnet, Elektronenakzeptoren als Antiauxochrome. Verschieben sie das Absorptionsmaximum in den längerwelligen Bereich, spricht man von einem bathochromen Effekt (Gegenteil: hypsochromer Effekt). Diese Gruppen bestimmen die Farbigkeit stärker als die Anzahl der konjugierten Doppelbindungen.
Auswertung des Versuchs (II)
Nicht nur die Veränderung der Größe des Systems delokalisierter π-Elektronen wirkt sich auf die Farbigkeit aus. Auch die Fähigkeit des Broms, im Rahmen mesomerer Grenzformeln Elektronen zur Verfügung zu stellen (-> bathochromer Effekt), hat einen Einfluss, der jedoch (je nach Grad der Bromierung) hinter seinem -I-Effekt (->hypsochromer Effekt) zurücktritt.
- Formuliere die Reaktionsgleichung und den Reaktionsmechanismus für die einfache Bromierung von Lycopin.
- Recherchiere die Strukturformeln einiger natürlicher Farbstoffe (z.B. aus Färber-Wau, aus Cochenille-Läusen oder Karotten) und markiere Chromophor und eventuelle (Anti)-Auxochrome farbig.
- Skizziere mögliche mesomere Grenzformeln.
DIese Inhalte kannst Du im Buch auf den Seiten 412-416 nachlesen.
https://www.tutory.de/entdecken/dokument/e37d0a9d


