Energiediagramme bei chemischen Reaktionen
Wenn bei einer chemischen Reaktion Energie an die Umgebung abgegeben wird, liegt eine exotherme Reaktion vor. Wenn die Stoffe bei der Reaktion Energie aufnehmen, ist die Reaktion endotherm. Man kann also betrachten, ob die Stoffe nach der Reaktion mehr oder weniger Energie besitzen als vorher.
Das kann in einem Energiediagramm dargestellt werden. Ein Energiediagramm vergleicht die Energie der Edukte und Produkte einer chemischen Reaktion. Die Energie wird als Säule an einem Energiepfeil dargestellt. Die Höhe der Säule hängt von der Menge der Energie ab.
Bei einer exothermen Reakion wird Energie abgegeben. Die Säule für die Energie der Edukte ist daher höher, als die Säule für die Produkte. Bei einer endothermen Reaktion ist die Säule für die Energie der Produkte höher, da die Edukte bei der Reaktion Energie aufnehmen.
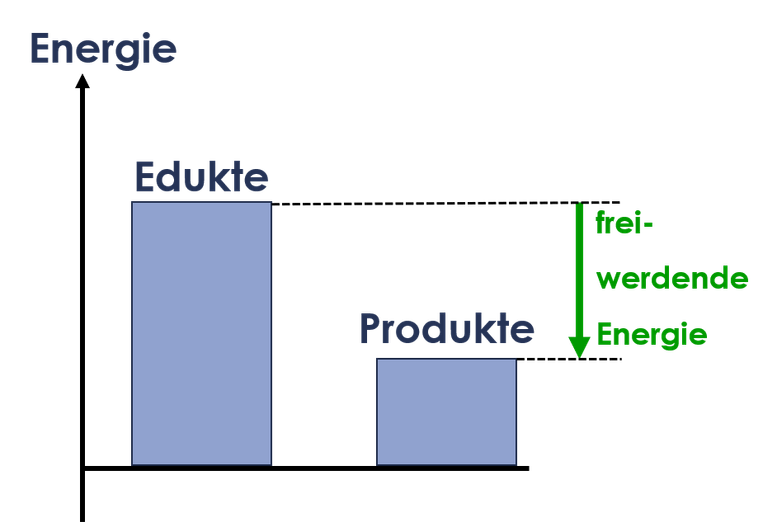
Reaktion
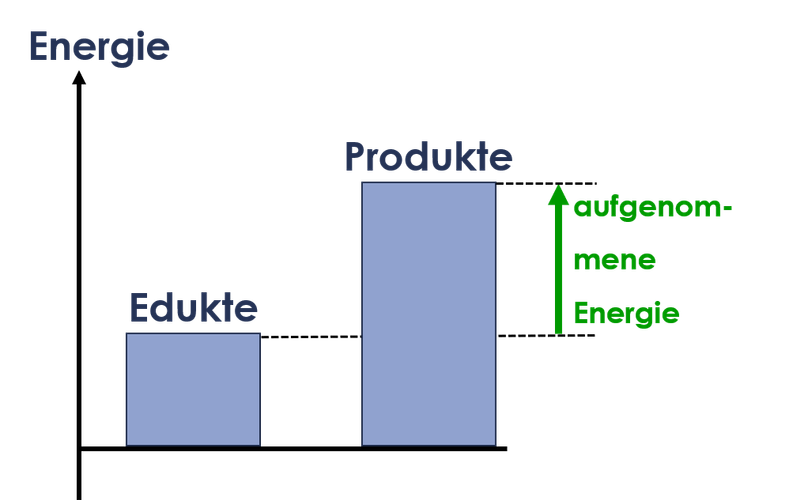
Reaktion
Gib an, ob es sich um eine exotherme oder endotherme Reaktion handelt.
In einem Becherglas werden zwei Salze vermischt. Sie verfärben sich schwarz und es ist eine deutliche Abkühlung zu fühlen.
Ein Gemisch aus Eisen und Schwefel wird kurz erhitzt. Danach glüht es hell auf und brennt mit gelber Flamme.
Eiweiß wird in einem Reagenzglas ständig erwärmt. Es verfärbt sich weiß und wird fest.
https://www.tutory.de/entdecken/dokument/energiediagramme


