Nachdem du nun weißt, wie man die Ladung von Ionen bestimmt, kannst du nun auch die Formel von Ionenverbindungen bestimmen, von denen du nur weißt, welche Ionen enthalten sind.
Aus der Formel ergibt sich auch die systematische Benennung der Verbindung.
Wie du bei beiden Aufgabetypen vorgehen musst, wirst du auf diesem Arbeitsblatt erfahren.
Kurzschreibwiese mit Atomsymbolen, die die Anzahl der Atome der chemischen Elemente angibt, die in einer Verbindung enthalten sind.
Bestimmung der Formel von einfachen Ionenverbindungen
Um diese Art von Aufgaben beliebig oft üben zu können, siehst du gleich links einen QR-Code bzw. einen Kurzlink zu einem interaktiven Online-Arbeitsblatt. An einem Beispiel wird nun erklärt, wie man auf die Formel kommt. Dabei werden Screenshots vom interaktiven Arbeitsblatt verwendet, damit du auch gleich lernst, wie du damit umzugehen hast.

1. Schritt: Bestimme die Ladungen der beiden Ionen.

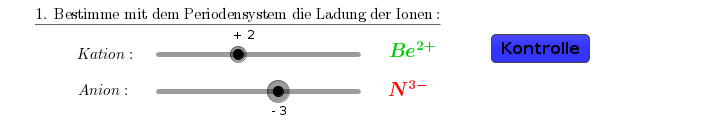
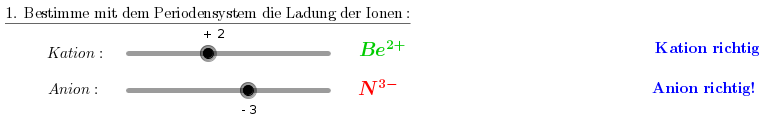
2. Schritt: Wieviele Ionen brauche ich von jeder Sorte, damit die Menge an positiver und negativer Ladung ausgeglichen ist?

https://www.tutory.de/entdecken/dokument/formeln-und-namen-von-ionenverbindungen

Natürlich kann man sich das auch ohne die Rechtecke verdeutlichen, indem man rechnet:
So ist die positive und die negative Ladung ausgeglichen.
Damit ist klar, wie die Formel, der Verbindung aus Beryllium und Stickstoff lauten muss.
Wie wir schon einmal geübt haben, muss die Anzahl der Atome (bzw. hier der Ionen) hintendran, tiefer gestellt als Index geschrieben werden. In der Formel der Ionenverbindung gibt man aber die Ladung nicht mehr an.
Zusammen ergibt das die Formel:
Im interaktiven Arbeitsblatt muss die Formel nicht eingeben werden. Überlege dir die Formel im Kopf oder schreibe sie auf und lass dir dann die Lösung anzeigen.


Neben der Formel wird im interaktiven Arbeitsblatt auch noch der Name angegeben. Wie der zustande kommt, wird als nächstes besprochen.
Bestimmung des systematischen Namens von Ionenverbindungen
Die Metallionen sind fast immer positiv geladen (Kationen) und werden nach dem Metall selber benannt. Sie stehen in den Formeln und im Name immer vorne.
Die Nichtmetallionen stehen in einer Formel immer hinten und enden immer auf -id. Einige der Namen entsprechen den deutschen Namen mit der Endung -id, wie -chlorid, -bromid usw. Bei anderen verwendet man den Namen, von dem sich auch das Elementsymbol herleitet, wie z.B. -oxid, -sulfid, -nitrid usw. Die Nichtmetalle bilden immer negativ geladene (Anionen).
https://www.tutory.de/entdecken/dokument/formeln-und-namen-von-ionenverbindungen
Viele Verbindungen haben sogenannte Trivialnamen, die historischen Ursprungs sind. So wird die Verbindung NaCl Kochsalz genannt. Der systematische Name dagegen beschreibt, welche Elemente enthalten sind und wie viele der jeweiligen Atome bzw. hier Ionen in der Formel enthalten sind. Beim Kochsalz lautet der Name Natriumchlorid.
In der Chemie sind Trivialnamen Namen für Stoffe, die nicht der systematischen chemischen Nomenklatur entsprechen und keine Rückschlüsse auf die Zusammensetzung einer chemischen Verbindung erlauben.
Nach festen und eindeutigen Regeln bestimmter Name, der einen Rückschluss auf die Summenformel erlaubt.
Beim Kohlendioxid (genauer: Kohlenstoffidoxid) haben wir eine Verbindung mit der Formel CO₂ was bedeutet, dass ein Kohlenstoffatom auf zwei Sauerstoffatome kommen. Die Vorsilbe "di" vor dem "oxid" gibt das Gleiche im Namen an.
Diese Vorsilben muss man auswendig lernen!!!
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
mono | di | tri | tetra | penta | hexa | hepta | octa | nona | deca |

Die Vorsilbe "mono" wird meist weggelassen, außer man will besonders auf den Unterschied zu einer ähnlichen Verbindung hinweisen, wie bei Kohlenmonoxid CO statt Kohlendioxid CO₂.
(Hier wird auch ein doppeltes "o" verschluckt!)
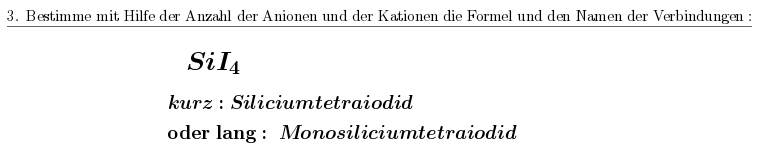
Hier ein Beispiel, wo die Vorsilbe "mono" im systematischen Name vorkommt, oder eben auch weggelassen werden kann.
Hier ein Beispiel, wo die Vorsilbe "mono" im systematischen Name vorkommt, oder eben auch weggelassen werden kann.
https://www.tutory.de/entdecken/dokument/formeln-und-namen-von-ionenverbindungen


