Untersuchung der Reaktion von Salzsäure mit Metallen
Auf einem neu gekauften Reinigungsmittel findest du folgende Hinweise:
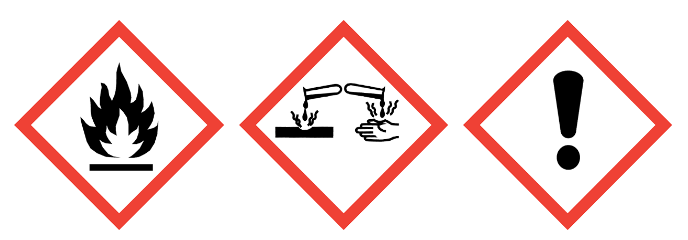
Enthält Chlorwasserstoff (HCl).
Kann gegenüber Metallen korrosiv sein.
Du fragst dich, was das bedeutet, und beschließt, den rätselhaften Hinweisen mit einem Experiment auf den Grund zu gehen.


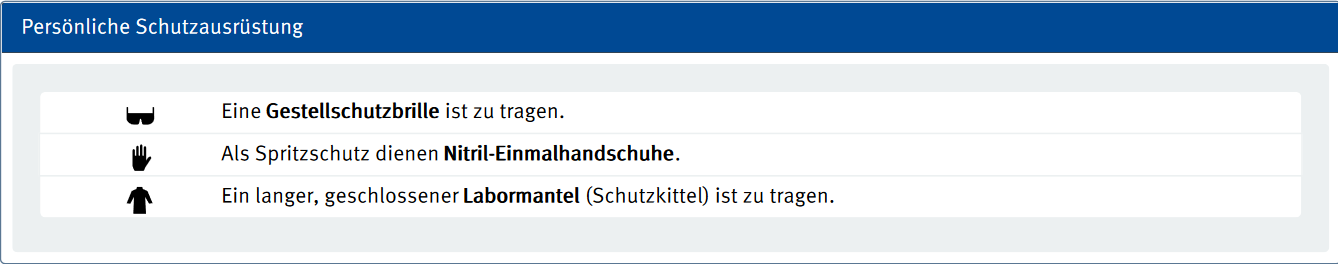
Sicherheitshinweise


Material
Benötigte Materialien:
1 Reagenzglasständer
5 Reagenzgläser
1 Pasteur-Pipette 5 mL
1 Pasteur-Pipette 2 mL
5 Objektträger (Glas)
1 Reagenzglashalter
1 Heizplatte
Benötigte Chemikalien:
Salzsäure 1M
Destilliertes Wasser
Magnesium (Granulat)
Eisen (Pulver)
Blattgold
https://www.tutory.de/entdecken/dokument/untersuchung-der-reaktion-von-salzsaeure-mit-metallen
Versuchsbeschreibung
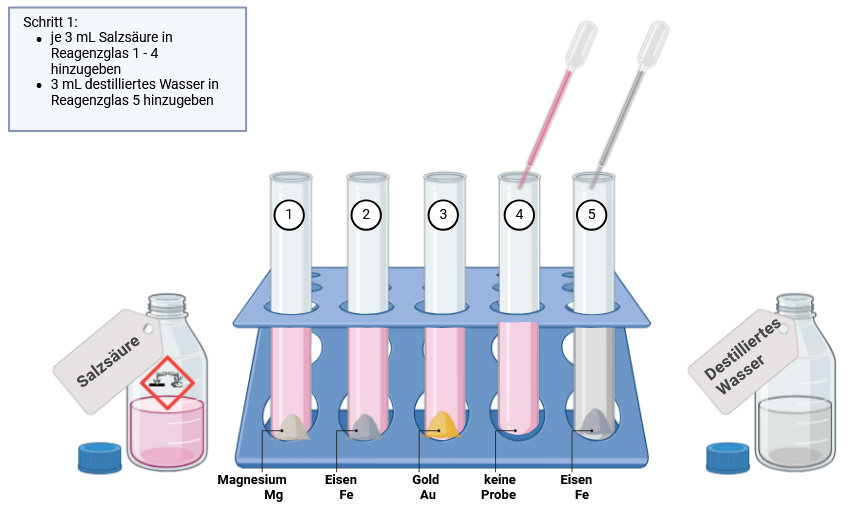
Halte deine Beobachtungen in der Tabelle auf der nächsten Seite fest, bevor du mit Schritt 2 weitermachst!

https://www.tutory.de/entdecken/dokument/untersuchung-der-reaktion-von-salzsaeure-mit-metallen
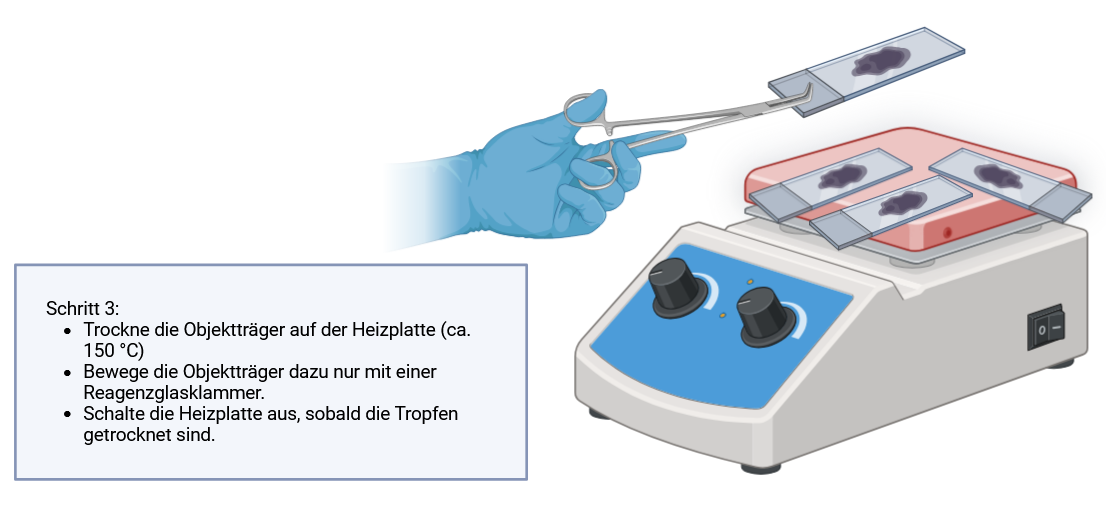
Halte deine Beobachtungen in der folgenden Tabelle fest!
Reagenz-Glas
Beobachtung im Reagenzglas
Beobachtung auf dem Objektträger
1
Magnesium
+
Salzsäure
2
Eisen
+
Salzsäure
3
Gold
+
Salzsäure
4
nur
Salzsäure
5
Eisen
+
Wasser
https://www.tutory.de/entdecken/dokument/untersuchung-der-reaktion-von-salzsaeure-mit-metallen
Auswertung
Verschiedene Metalle reagieren unterschiedlich, wenn sie mit Salzsäure in Kontakt kommen. Unedle Metalle wie und lösen sich in Salzsäure auf. Dabei entsteht ein Gas. ist edler als , weshalb es weniger leicht mit der Salzsäure reagiert als .
Edle Metalle wie verhalten sich anders. reagiert nicht mit Salzsäure. Es bleibt unverändert und löst sich nicht auf. Edle Metalle sind beständiger und reagieren nicht so leicht wie unedle Metalle.
Stelle deine Vermutungen anhand der chemischen Summenformeln der Ausgangsstoffe auf.
Schau in den Umschlag, der am Abzug versteckt ist.
Gas
Nachweis-Methode
https://www.tutory.de/entdecken/dokument/untersuchung-der-reaktion-von-salzsaeure-mit-metallen
Diese Stoffe sehen anders aus und haben andere chemische Eigenschaften, als die unedlen Metalle.
Um welche Stoffklasse könnte es sich bei den neuen Stoffen handeln?
Ein Hinweis ist bei den Schutzbrillen versteckt.
Salzsäure reagiert mit unedlem Metall zu und .
Die Salze der Salzsäure heißen .
Salzsäure reagiert mit Magnesium zu und .
https://www.tutory.de/entdecken/dokument/untersuchung-der-reaktion-von-salzsaeure-mit-metallen



