die exotherme Reaktion
Hintergrundwissen
Zum Herstellen kohlensäurehaltiger Getränke wird gasförmiges Kohlenstoffdioxid in Wasser geleitet. In der folgenden Gleichgewichtsreaktion werden dabei Hydrogencarbonat- und Oxonium-Ionen gebildet:
Kohlenstoffdioxid und Wasser stehen im Gleichgewicht mit Hydrogencarbonat- und Oxonium-Ionen.
CO2(g)+2 H2O(l)⇌HCO3−(aq)+H3O+(aq)
Versuch
Material
2x Kunststoffspritze (á 50 mL)
1x Dreiwegehahn
2x Becherglas (ca. 250 mL)
1x Becherglas (ca. 100 mL)
Stoffe
dest. Wasser
Kohlenstoffdioxid
Universalindikator
kaltes Leitungswasser (ggf. Eiswürfel)
heißes Leitungswasser
Aufbau
Fülle jeweils eines der großen Bechergläser mit heißem bzw. kaltem Leitungswasser.
Fülle ca. 50 mL dest. Wasser in das kleine Becherglas und gib zwei bis drei Tropfen Universalindikator in das dest. Wasser.
Ziehe ca. 25 mL dest. Wasser in eine der Spritzen auf.
Die andere Spritze ist bereits mit Kohlenstoffdioxid befüllt.
Verbinde die zwei Kunststoffspritzen mit dem Dreiwegehahn und stelle den Hahn so ein, dass die Spritzen miteinander verbunden sind.
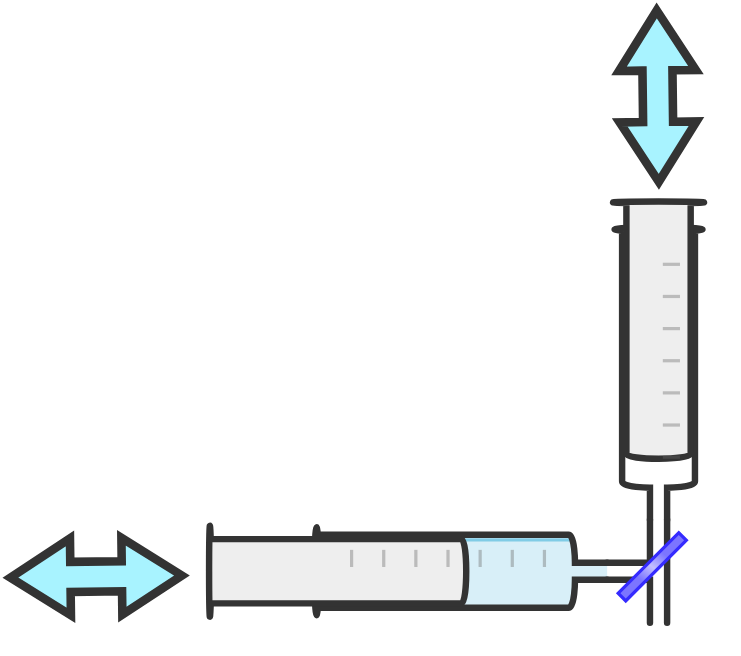
Durchführung
Drücke das Gas mit Hilfe der Spritzen immer wieder durch die Flüssigkeit hin und her, bis das Gasvolumen sich nicht mehr verändert.
Notiere deine Beobachtungen auf der Rückseite. Lies dabei auch das Gasvolumen ab!
Überführe die Flüssigkeit in eine der beiden Spritzen, verschließe diese und trenne die andere Spritze vom Dreiwegehahn.
Erwärme die Spritze mit der Flüssigkeit gründlich im heißen Leitungswasser. Schließ die andere Spritze wieder an und wiederhole Schritte 1 bis 3.
Lass die Spritze mit der Flüssigkeit im kalten Leitungswasser gut abkühlen. Schließ die andere Spritze wieder an und wiederhole Schritte 1 bis 3.
https://www.tutory.de/entdecken/dokument/versuch-temperaturabhaengigkeit-von-gleichgewichtsreaktionen
Beobachtungen & Auswertung
Beobachtungen
Auswertung
bei Raumtemperatur
erwärmt
gekühlt
Aufgaben
https://www.tutory.de/entdecken/dokument/versuch-temperaturabhaengigkeit-von-gleichgewichtsreaktionen
Bei chemischen Reaktionen findet neben einem Stoffumsatz immer auch ein Energieumsatz statt. Dabei wird Energie aufgenommen oder abgegeben.
exotherm →
CO2(g)+2 H2O(l)⇌HCO3−(aq)+H3O+(aq)
← endotherm
Formulierungshilfen
eine Verringerung der Temperatur begünstigt
eine Erhöhung der Temperatur begünstigt
die endotherme Reaktion
chemische Gleichgewichtsreaktion
Verschiebung des Gleichgewichts
Anwendungsaufgabe
Das braune Gas Stickstoffdioxid (NO2) steht mit dem farblosen Gas Distickstofftetraoxid (N2O4) im Gleichgewicht:
exotherm →
2 N2O(g)⇌N2O4(g)
← endotherm
- Klicken Sie doppelt oder auf den Stift, um den Inhalt direkt im rechten Menü zu bearbeiten.
- Nutzen Sie den roten Zauberpinsel oben rechts im Menü des Bausteins, um seinen Inhalt zu leeren.
https://www.tutory.de/entdecken/dokument/versuch-temperaturabhaengigkeit-von-gleichgewichtsreaktionen


