Versuch zum Oxidationsvermögen einzelner Metalle
Materialen: Eisennagel, Kupferblech;
Kupfer(II)sulfat-,Magnesium(II)sulfat, Zink(II)suflat-, Silber(I)nitrat-Lösung.
Versuchsdurchführung:
Tauchen Sie den blanken Eisennagel oder das blanke Kupferblech jeweils einmal in die Zinn-, einmal in die Silber- und einmal in die Magnesiumlösungen. Anschließen tragen Sie in die Tabelle ein, ob eine Reaktion stattfindet oder nicht.
Beobachtung:
Eisen | Kupfer | |
Zinnionen | Beobachtung: Redoxreaktion: Sn2+ -> Fe -> ______________________ Sn2+ + Fe -> | Beobachtung: Redoxreaktion: Sn2+ -> Cu -> ______________________ Sn2+ + Cu -> |
Silberionen | Beobachtung: Redoxreaktion: Ag+ -> Fe -> ______________________ Ag+ + Fe -> | Beobachtung: Redoxreaktion: Ag2+ -> Cu -> ______________________ Ag+ + Cu -> |
Magnesiumionen | Beobachtung: Redoxreaktion: Mg2+ -> Fe -> ______________________ Mg2+ + Fe -> | Beobachtung: Redoxreaktion: Mg2+ -> Cu -> ______________________ Mg2+ + Cu -> |
Zinkionen | Beobachtung: Redoxreaktion: Zn2+ -> Fe -> ______________________ Zn2+ + Fe -> | Beobachtung: Redoxreaktion: Zn2+ -> Cu -> ______________________ Zn2+ + Cu -> |
https://www.tutory.de/entdecken/dokument/versuch-zum-oxidationsvermogen-einzelner-metalle-2
Auswertung:
1) Beschreiben Sie in einem Stichpunkt ihr Beobachtung.
2) Formulieren Sie ggf. die entsprechenden Redoxgleichung.
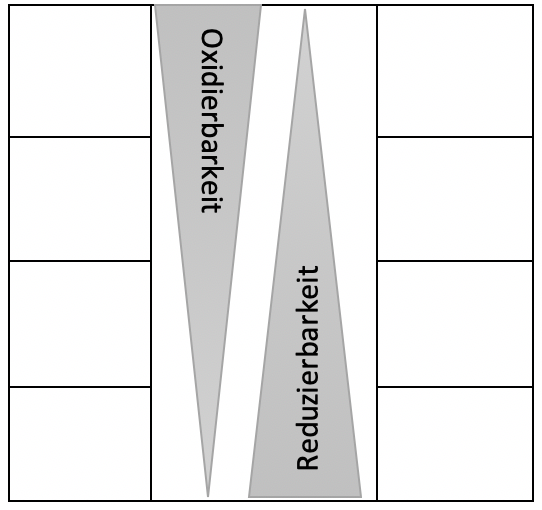
3) Sortieren Sie die Metalle nach ihrer Oxidierbarkeit und die Metallionen nach ihrer
Reduzierbarkeit in die Tabelle.
Eine Redoxreaktion ist eine chemische Reaktion, bei der ein Reaktionspartner Elektronen auf den anderen überträgt. Bei einer solchen Elektronenübertragungs-Reaktion finden also eine Elektronenabgabe (Oxidation) durch einen Stoff sowie eine Elektronenaufnahme (Reduktion) statt.
Bei der Oxidation steigt die Oxidationszahl.
Bei der Reduktion sinkt die Oxidationszahl.
4) Al3+ist ein weiteres Metall. Begründen Sie mit Ihrem Wissen aus dem Experiment und der Abbildung mit wlechen der heute verwendeten Metallionen Aluminium reagieren kann.
https://www.tutory.de/entdecken/dokument/versuch-zum-oxidationsvermogen-einzelner-metalle-2


