Bestandsaufnahme

Bisher unterscheiden wir in endotherme und exotherme Reaktionen, wobei der Energieumsatz der Indikator für den einen oder den anderen Reaktionstyp ist.
Wie rechts zu sehen ist, muss dem System ausgehend vom Energieniveau der Edukte aus Aktivierungsenergie zugeführt werden, bevor dann das Energieniveau des Produkts erreicht wird. Die dabei scheinbar verlorene
Energie entweicht dem System meist als Wärme.
Die Sache mit der Messbarkeit
Messinstrumente
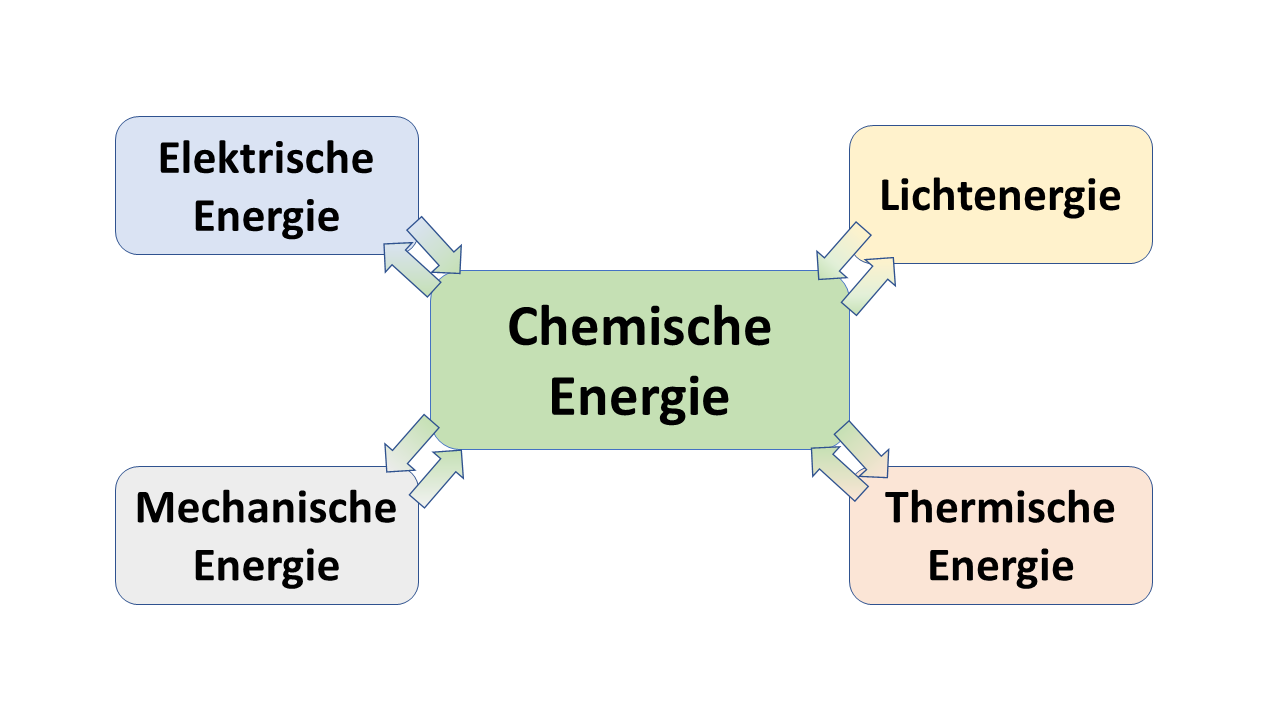
Leider existiert kein Messinstrument, das den Energiegehalt an eines chemischen Systems so einfach messen kann wie die Temperatur (Thermometer) oder Spannenergie (z.B. Federkraftmesser). Eine direkte Messung scheidet als Möglichkeit also aus.
Als Alternative bietet sich an, die bei einer Reaktion benötigte oder frei werdende Wärmeenergie zu bestimmen. Dafür gibt es Messinstrumente. Wir müssen jedoch die Grundzusammenhänge der Energieumwandlung beachten:
Energie kann also niemals "verloren" gehen - wenn wir ein niedrigeres Niveau chemischer Energie erreichen, muss im gleichen Zug das Niveau einer anderen Energie steigen (eine weitere Einschränkung durch den 2. Hauptsatz der Themodynamik betrachten wir später).
Energieumwandlung
Die Energie eines abgeschlossenen Systems bleibt unverändert. Verschiedene Energieformen können sich demnach ineinander umwandeln, aber Energie kann weder aus dem Nichts erzeugt noch kann sie vernichtet werden.
1. HS in Formeln: dU = dQ + dW
dU: innere Energie des Systems, dQ: ausgetauschte Energie, dW: Arbeit (meist: Volumen)
- Entwickle einen Versuchsaufbau, mit dem die beschriebene Temperaturänderung so genau wie möglich gemessen werden kann.
- Prüfe Deinen Versuchsaufbau anhand der Kriterienliste rechts (alternativ: https://t1p.de/ASS-QualiKalori)
https://www.tutory.de/entdecken/dokument/waerme-enthalpie-und-satz-von-hess
Kalorimetrie und Wärmemenge
Funktionsprizip: Kalorimeter
Um die mit der Umgebung ausgetauschte Wärmeenergie ("Reaktionswärme") zu bestimmen, wird das Verfahren der Kalorimetrie angewandt. Dabei wird in einem abgeschlossenen Reaktionsraum eine Reaktion durchgeführt und die Temperaturänderung eines umgebenden Wasserbades gemessen (bei Lösevorgängen kann u.U. auch direkt im Solvens gemessen werden).
Kalorimetrie eignet sich nur für Reaktionen, die (annähernd) vollständig, schnell und mit deutlich messbarer Temperatur-änderung ablaufen.
Für die Messung muss neben den genauen Stoffmengen der Edukte und den Temperaturen vor und nach der Reaktion auch die genaue Masse des enthaltenen Wassers bekannt sein, um von dessen Temperaturänderung die übertragene Energie berechnen zu können.
- Wenn Dir die Beschreibung zu abstrakt ist, kann dieses Video helfen:
https://t1p.de/ASS-KaloriSolv (beachte, dass die Isolierung hier weggelassen wurde)
Definition und Berechnung der Wärmemenge
Da die Temperaturänderung von Reaktionsgemischen oft nicht gut messbar ist, wird stattdessen die Erwärmung des umgebenden Wassers gemessen. Wichtig ist dabei, dass die Temperaturdifferenz ΔT (=T2 - T1) proportional zur vom Wasser aufgenommenen Energiemenge ist: Je aufgenommene 4,18 Joule Energie kann 1 Gramm Wasser um 1 °C erhitzt werden. Dieser stoffabhängige Proportionalitätsfaktor wird als spezifische Wärmekapazität bezeichnet (hier: von Wasser).
Anhand der gemessenen Temperaturdifferenz des Wassers im Kalorimeter kann nun die bei der Reaktion freigesetzte (bzw. verbrauchte) und an das Wasser weitergegebene (bzw. diesem entzogene) Wärmemenge qr berechnet werden:
cp(Wasser) = 4,18 J · g-1 · K-1
J : Joule, K: Kelvin
- Erkläre die Formel mit eigenen Worten (Tipp:
Warum lässt sich so die Energie berechnen?
) - Bei der Zugabe von Zinkpulver in Kupfer(II)sulfatlösung wird in einem Kalorimeter mit 100 g Wasser eine Temperaturerhöhung von 293,15 K auf 296,65 K gemessen. Berechne qr.
Die Lösungen findest Du auf der nächsten Seite.
https://www.tutory.de/entdecken/dokument/waerme-enthalpie-und-satz-von-hess
Lösungen
Für jedes Grad, das ein Gramm Wasser erwärmt wurde, wurden 4,18 Joule aufgenommen. Multipliziert man diese Energiemenge mit der Masse des Wassers in Gramm, erhält man die aufgenommene Wärmeenergie in Joule.
gegeben:
Berechnung:
Da diese Energie dem Reaktionsgemisch verloren ging, ist das Vorzeichen umzukehren: qr = -1463 J.
Stoffmenge berücksichtigen: molare Reaktionswärme Qr
Eigentlich fehlt in dem Beispiel eine Angabe: Der Stoffumsatz, angegeben als molarer Formelumsatz. Dieser wird wie folgt ermittelt:
1.: Die Reaktionsgleichung wird so formuliert, dass die stöchiometrischen Koeffizienten minimal, aber noch ganzzahlig sind.
2.: Jeder stöchiometrische Faktor wird mit einem Mol multipliziert.
3.: Bezogen auf einen Stoff beträgt der Formelumsatz 1 Mol, wenn genau die errechnete Stoffmenge an der Reaktion beteiligt ist.
Beispiel:
Ein Formelumsatz von einem Mol (FU = 1 Mol) liegt vor, wenn 3 Mol Wasserstoffmoleküle (oder 1 Mol Stickstoffmoleküle) reagieren. Reagieren 6 Mol Wasserstoffmoleküle, so beträgt der Formelumsatz 2 Mol.
Berechnung der molaren Reaktionswärme Qr
Die errechnete Wärmemenge qr wird durch die Anzahl der molaren Formelumsätze geteilt, um die molare Reaktionswärme Qr zu erhalten:
Die Einheit der molaren Reaktionswärme lautet damit J / Mol.
Koeffizienten sind minimal & ganzzahlig
- Bestimme die molare Reaktionswärme Qr.
- Warum muss das Zinkpulver nicht so genau abgewogen werden? Warum sollte dennoch nicht viel zu viel Zink zugegeben werden?
https://www.tutory.de/entdecken/dokument/waerme-enthalpie-und-satz-von-hess
Von der Reaktionswärme zur Reaktionsenthalpie
Die Reaktionswärme gibt nicht vor, ob die Reaktion bei konstantem Volumen oder bei konstantem Druck vor sich geht. Die bei konstantem Druck ermittelte Reaktionswärme wird auch als Reaktionsenthalpie ΔHR (bzw., auf 1 mol Formelumsatz berechnet, ΔrHm) bezeichnet.
Findet die Reaktion zudem bei Standardbedingungen (SATP, 25°C, 1 bar) statt, liegt sogar die molare Standardreaktionsenthalpie ΔrHm0 vor.
Nulllevel und Standardbildungsenthalpie
Wie schon erwähnt wurde, kann der aktuelle Gehalt an chemischer Energie nicht gemessen werden. Mit der Reaktionsenthalpie (und der Kalorimetrie) existiert aber eine Möglichkeit, die Änderung der inneren Energie zu ermitteln.
Reagieren Elemente bei Standardbedingungen zu einer Verbindung, dann ist die bei der Bildung von einem Mol dieses Produkts beobachtete Enthalpieänderung gleichzeitig die so genannte molare Standardbildungsenthalpie ΔfHm0 (auch ΔBHm0, ΔBH0 oder ΔfH0).
Um einen Bezugspunkt zu haben, wird die molare Standardbildungsenthalpie für Elemente willkürlich auf 0 J/mol festgelegt. Existieren verschiebene elementare Ausprägungen (wie Diamant und Graphit bei Kohlenstoff), so erhält die stabilste Modifikation (hier: Graphit) die molare Standardbildungsenthalpie 0 J/mol. Für (fast) alle anderen Verbindungen lässt sich die molare Standardbildungsenthalpie im Tafelwerk nachschlagen.
Der Weg ist egal: Satz von Hess
Germain Henri Hess stellte den Hess'schen Wärmesatz (auch: Satz von Hess) auf, der besagt, dass die Reaktionsenthalpie nur vom Anfangs- und Endzustand des Systems (hier: Produkten und Edukten), nicht aber vom Reaktionsweg abhängt.
Ob Kohlenstoff (hier: Graphit) also in einem Schritt oder über das Zwischenprodukt Kohlenstoffmonooxid zu Kohlenstoffdioxid reagiert, ist für die dabei frei werdende Energie unerheblich (Abb. 4).
Die Reaktionsenthalpie für die direkte Bildung von CO2 entspricht der Summe der Reaktionsenthalpien für die schrittweise Bildung über das Zwischenprodukt CO.

Anwendung: Berechnung der Reaktionsenthalpie
Probiere das anhand der rechts verlinkten Übungsaufgaben des Spalatingymnasiums einmal aus.
https://t1p.de/Spalatin-Hess
Achtung: ersetze in der 1. Lösung O2 durch Cl2
https://www.tutory.de/entdecken/dokument/waerme-enthalpie-und-satz-von-hess


