CO2 in Atmosphäre und Lithosphäre – Teile des natürlichen Kalkkreislaufs
M1: Verwitterung von Kalkgestein
Kalkgesteine sind vor Jahrmillionen als Sedimentgestein aus Schalen und Skeletten von im Meer lebender Organismen entstanden. Durch die Plattentektonik gelangten sie an die Oberfläche und sind heute Teil von Gebirgen wie den Kalkalpen.
In regenreichen Gebieten sind diese Kalkgesteine oft von Löchern an der Oberfläche (s. Abb. 1) und darunter liegenden Höhlensystemen durchzogen. Dies gilt insbesondere, wenn die Kalkschichten von mikroorganismenhaltigen und damit kohlenstoff-dioxidreichen Bodenschichten bedeckt sind.

Dabei ist Kalk (Calciumcarbonat, CaCO3) in Wasser nahezu unlöslich. Festes Calcium-carbonat und gelöstes Calciumhydrogencarbonat stehen aber in einem Gleichgewicht:
Der Anteil von Carbonat- zu Hydrogencarbonat-Ionen in der Lösung hängt vom pH-Wert ab (s. M3). Aus der Lösung von Hydrogencarbonat (HCO3 -) lässt sich im Übrigen nie Calcium-hydrogencarbonat als Feststoff ausfällen. Beim Eindampfen entsteht stets Calciumcarbonat.
- Fassen Sie die an der Verwitterung von Kalk beteiligte Faktoren zusammen (M1, Vorwissen).
- Erklären Sie anhand der Beobachtungen aus V1, dass sich in Calciumhydroxid-Lösungen (alkalisch, sehr hoher pH-Wert) bei Zugabe von Kohlenstoffdioxid zunächst Carbonat-Ionen bilden, aus denen fester Kalk entsteht.
- Klären Sie anhand der Beobachtungen zu V2, ob die Zugabe von weiterem Kohlenstoffdioxid für die Entstehung der o. g. Löcher verantwortlich sein kann.
- Werten Sie die Experimente aus. Erläutern Sie unter Verwendung von Reaktionsgleichungen die Entstehung der Löchern im festem Kalkgestein.
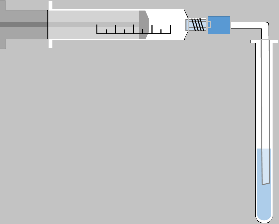
M2: Versuche
V1 - Entstehung von fein verteiltem Kalk
V1 - Entstehung von fein verteiltem Kalk
Material
• Schutzbrille
• 1 Spritze (30 mL)
• Reagenzglas samt Halter
• Schlauch
Chemikalien
• Calciumhydroxidlösung (Ca2+(aq) + 2 OH-(aq))
• Universalindikator
• CO2 aus Spender
Aufbau:
Sicherheitshinweise: Schutzbrille tragen, Kalkwasser reizt die Haut und verursacht schwere Augenreizungen. Kohlenstoffdioxid nicht direkt aus dem Spender in das Kalkwasser einleiten, sondern zunächst abfüllen, um ein Herausspritzen des Kalkwassers zu vermeiden. Reste über den Abguss entsorgen.
Durchführung:
3 Tropfen Universalindikator und 10 mL Calciumhydroxid-Lösung werden in ein Reagenzglas gegeben.
Aus der Spritze werden über den Schlauch wenige Milliliter Kohlenstoffdioxid hinzugefügt bis sich gerade ein Niederschlag bildet.
Beobachtungen auf der nächsten Seite
https://www.tutory.de/entdecken/dokument/wie-kommt-das-loch-in-den-kalkboden-gleichgewichtsreaktionen-bei-der-dolinenbildung

Beobachtungen:
Im offenen Reagenzglas erkennt man nach Zugabe von 20–40 mL Kohlenstoffdioxid, dass sich fein verteilter Kalk bildet. (Abbildung rechts)
V2 - Modellexperiment zur Verwitterung von Kalk

Material, Chemikalien, Aufbau und Sicherheit: siehe V1
Durchführung:
In die Flüssigkeit mit dem feinverteilten Kalk und dem Indikator wird nun durch schrittweise Zugabe von Kohlenstoffdioxid geprüft, ob sich der pH-Wert verändert und der Niederschlag wieder auflöst.
Beobachtungen:
siehe rechts - die Farbe der Flüssigkeit wechselt über grün zu gelb, die Trübung nimmt in den letzten Schritten merklich ab.
M3: Zusatzinformationen
Bisher sind wir immer davon ausgegangen, dass beim Lösen von Kohlenstoffdioxid in Wasser Kohlenstoffdioxid, Hydrogencarbonat und Carbonat-Ionen gleichermaßen vorliegen. In Wahrheit hängt die Lage der Gleichgewichte aber stark von der Konzentration der Oxonium-Ionen (H3O+) und damit vom pH-Wert ab.
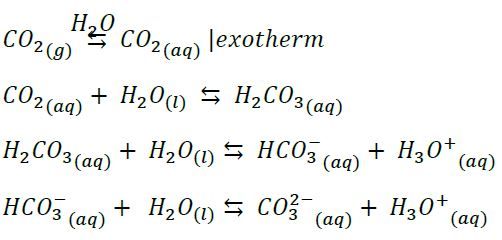
In Gegenden mit Kalkgesteinen gibt es viele Mineralwasserquellen, die reich an Calcium-Ionen sind. Allerdings enthalten sie wenig bis gar kein Carbonat, wie das Beispiel-Etikett rechts zeigt, dafür aber viel Hydrogencarbonat.
In Gegenden mit kalkhaltigen Böden kann es bei der Verwendung des dort gewonnenen Trinkwassers im Haushalt zu Kalkablagerungen in Heißwasserkochern kommen.
- Erläutern Sie diese beiden o. g. Tatsachen.
- Planen Sie ggf. ein Experiment, mit dem sich der letztgenannte Effekt zeigen lässt.


https://www.tutory.de/entdecken/dokument/wie-kommt-das-loch-in-den-kalkboden-gleichgewichtsreaktionen-bei-der-dolinenbildung
M4: Schematische Darstellung der Prozesse in der Tropfsteinhöhle unter der Doline
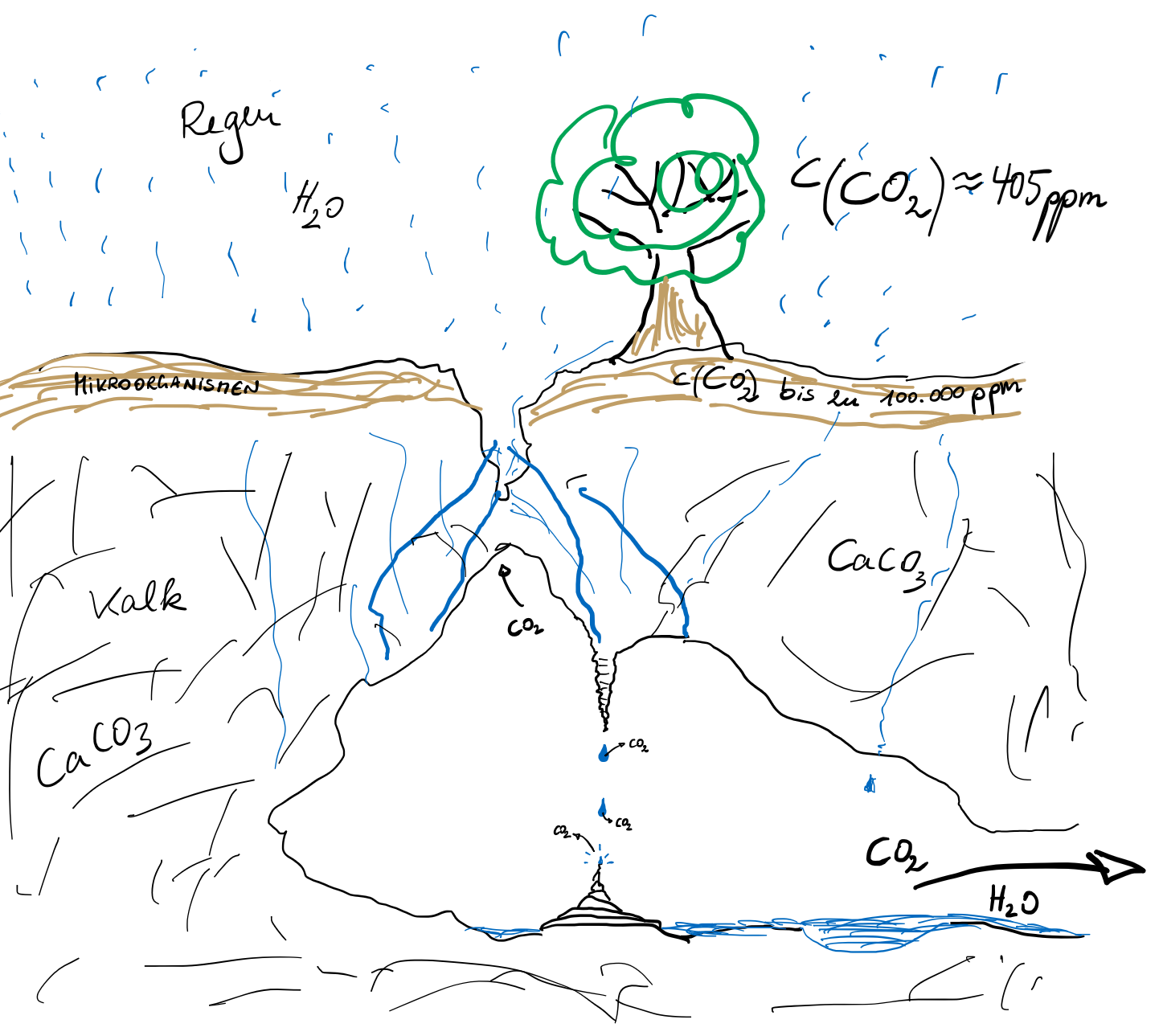
ppm: parts per million
- Erläutern Sie fachsprachlich richtig die Bildung von Tropfsteinen.
- Die Bildung von Tropfsteinen dauert tausende von Jahren. Nehmen Sie Stellung zu der Tatsache, dass in vielen für den Publikumsverkehr geöffneten Tropfsteinhöhlen die Besucherzahlen pro Jahr für die Höhlen mit Blick auf deren Erhalt für die Nachwelt stark reglementiert sind.
- Vergleichen Sie die beiden Phänomene der Kalkablagerung am Beispiel des Wasserkochers und der Tropfsteinhöhle mit Blick auf die jeweilige Störung des Gleichgewichts.
https://www.tutory.de/entdecken/dokument/wie-kommt-das-loch-in-den-kalkboden-gleichgewichtsreaktionen-bei-der-dolinenbildung


